La Leishmania
La leishmaniosi è una malattia protozoaria infettiva e contagiosa a carattere zoonosico ( può essere trasmessa all’uomo) generalmente ad andamento cronico. I protozoi del genere Leishmania sono parassiti intracellulari dei macrofagi e delle cellule dendritiche del cane, uomo ed altri animali selvatici. La leishmaniosi viene veicolata in Europa dalla puntura del Phlebotomus papatasi, comunemente chiamato pappatacio, insetto simile alla zanzara che funge da ospite intermedio. All’interno del vettore i protozoi si moltiplicano e diventano infettanti. I parassiti, nell’ospite definitivo, si moltiplicano all’interno del citoplasma di cellule della linea monocita-macrofagica. I parassiti appaiono dentro i macrofagi come organismi rotondeggianti od ovoidali. Questa forma di parassita, amastigote, viene ingerito dal flebotomo durante il pasto. Nel pappatacio subiscono parte del ciclo e vengono quindi nuovamente trasmessi all’ospite definitivo con una nuova puntura;Fagocitati dai macrofagi all’interno dei quali si moltiplicano raggiungono un numero tale da portare a rottura la cellula. Con la rottura delle cellule, gli amastigoti liberati invadono altri macrofagi. Due sono le specie responsabili della patologia canina: L. donovani infantum e L. donovani chagasi.
PATOGENESI
La capacità degli amastigoti di sopravvivere nei macrofagi e di disseminarsi nell’organismo dipende da fattori intrinseci del parassita e dal tipo di risposta immunitaria cellulo-mediata elaborata dall’ospite. La risposta immunitaria umorale è imponente ma non è protettiva. Il lento e continuo contatto dell’antigene parassitario con le cellule immunocompetenti è alla base dell’evoluzione patogenetica della malattia che è caratterizzata da:
- iperglobulinemia, in genere policlonale, associata alla continua stimolazione dei linfociti B che è causa dell’incremento delle proteine totali e dell’inversione del rapporto albumine\globuline.
- produzione di autoanticorpi, probabilmente per reazione crociata fra antigeni parassitari e antigeni self, causa di trombocitopenia e\o anemia.
- produzione e deposito di immunocomplessi, responsabili dei quadri di vasculite, glomerulonefrite e poliartrite.
La patogenesi delle lesioni cutanee non è stata ancora ben chiarita. Secondo alcuni la persistenza del parassita all’interno dei macrofagi costituirebbe un continuo stimolo per l’infiltrazione di cellule infiammatorie in sede dermica. Secondo altri, il deposito di immunocomplessi sarebbe la causa primaria della dermatite (simile al lupus all’istologico).
SINTOMATOLOGIA
Dopo un periodo di incubazione variabile da pochi giorni a più di un anno, la patologia può decorrere in maniera asintomatica o con sintomi molto vari:
- Linfoadenopatia periferica
- lesioni cutanee
- Congiuntivite e uveite
- Onigrifosi
- anoressia o aumento dell’appetito
- perdita di peso
- insufficienza renale
- febbre
- disturbi della deambulazione
- epistassi che può essere anche unilaterale e intermittente.
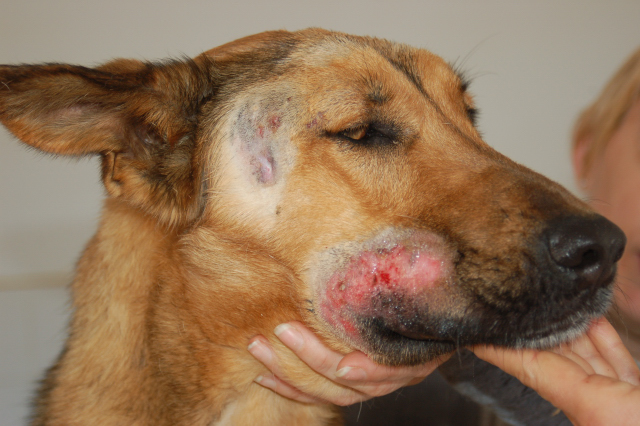
I segni cutanei sono tra i più importanti della malattia, le lesioni sono generalmente di natura cronica, simmetrica e non pruriginose. La forma più frequentemente riscontrata è quella di una dermatite secca esfoliativa con squame furfuracee che colpisce in particolare la zona perioculare, il dorso del naso, il padiglione auricolare con lesioni che possono manifestarsi come ulcere sanguinolente per poi estendersi a tutto il corpo. . Possibile formazione di ulcere specie sui cuscinetti plantari (colpiti anche da onicogrifosi e ipercheratosi) e sulle prominenze ossee.
DIAGNOSI
La diagnosi viene effettuata tramite:
- indagini sul sangue
- Esame delle urine
- prelievi citologici midollari e linfonodali tramite un esame microscopico e PCR Il sangue viene valutato quali-
quantitativamente nelle sue componenti cellulari (esame emocromocitometrico). Si può riscontrare aumento delle proteine totali e inversione del rapporto albumine/ globuline, in quelle proteiche plasmatiche (elettroforesi) e dal punto di vista immunologico, alla ricerca degli anticorpi indicanti il contatto col parassita (immunofluorescenza) o del parassita stesso (PCR); dall'esame del siero si ricavano informazioni sulla funzionalità degli organi interni, specie fegato e reni. L'urina dà informazioni sulla funzionalità renale, valutandone il peso specifico, il contenuto in proteine, le cellule presenti. In Italia vi sono zone endemiche: le isole e le aree costiere della Liguria , Toscana, Lazio, Campania, Marche, Abruzzi, Molise, Puglia. Zone endemiche anche in altri paesi che si affacciano sul Mar Mediterraneo (Grecia, Spagna, Francia, Malta) e in paesi a clima tropicale dell’Asia e del Sudamerica. La stagione dei flebotomi ha inizio con la comparsa dei primi caldi primaverili e termina con l’arrivo dell’ inverno. Si consiglia, visto l’assenza di un vaccino o di una profilassi efficace per scongiurare l’infezione di eseguire periodicamente dei test tramite un prelievo di sangue per accertare la positività o meno al parassita. Elemento prognostico decisivo è senza dubbio una diagnosi precoce di Leishmaniosi con immediato inizio delle dovute terapie prima che compaiano sintomi evidenziabili dal proprietari del cane. il periodo migliore per effettuare il test è fine estate inizio autunno (settembre-ottobre-novembre) specialmente se si è portato l’animale in aree endemiche durante la stagione estiva.
PROFILASSI
Non essendo ancora stato prodotto un vaccino, la profilassi per il cane non può limitarsi ad altro che alla protezione dagli insetti con collari repellenti a base di piretroidi sintetici come la deltametrina e la permetrina, con farmaci per uso spot-on (fiale da applicare sulla cute) e con sostanze naturali (aglio) che hanno dimostrato in test e ricerche scientifiche un elevato potere antifeeding sul flebotomo vettore. Poiché il pappatacio vive tra l’erba e colpisce soprattutto di notte, è meglio non far dormire il cane in giardino almeno nelle aree geografiche più colpite dalla malattia. La lotta ai flebotomi può essere condotta principalmente attraverso due tipi d'intervento: il primo prevede misure di protezione contro la puntura dei flebotomi; il secondo, teso a ridurre significativamente la densità di questi insetti, implica l'uso di insetticidi e/o operazioni di bonifica ambientale atte ad eliminare le cause favorenti il loro sviluppo larvale, in particolare in aree urbane e peri-urbane. Misure da prendere per la protezione individuale e collettiva in zone endemiche per leishmaniosi, oltre l'uso di repellenti, sono l'utilizzo di zanzariere a maglie molto fitte applicate a finestre e porte e l'evitare di soggiornare all'aperto durante le ore notturne nella stagione calda.
TERAPIA
Un farmaco efficace, poco costoso, senza effetti collaterali e facile da somministrare non è ancora disponibile. A tutt’oggi i trattamenti sono spesso lunghi, costosi ed inefficaci, considerando anche che gli intimi meccanismi immunitari che regolano la risposta del cane verso l’agente patogeno, non sono ancora completamente chiariti. Indubbiamente la risposta alla terapia è migliore quando il cane è (ancora) asintomatico, per cui sarebbe auspicabile sottoporre a trattamento farmacologico gli animali che non presentano segni clinici, in modo da evitare l’evoluzione della patologia in forme conclamate. Concetto questo piuttosto utopico, nella pratica clinica quotidiana, in quanto il proprietario conduce alla visita il cane quando si accorge che c’è qualcosa che non va, cioè quando l’animale presenta almeno qualche sintomo. I protocolli oggi in uso prendono in considerazione i suddetti farmaci: - L’antimoniato di N- metilglucamina ( Glucantime) è il farmaco più frequentemente utilizzato e va somministrato al dosaggio di 75 mg/kg/die, sottocute o intramuscolo, fino alla scomparsa dei sintomi clinici o alla normalizzazione del quadro proteico. Possibilità di farmaco resistenza, costo elevato e dolori muscolari La miltefosina (esadecilfosfocolina): La miltefosina è un analogo dei fosfolipidi strutturalmente simile ad alcuni composti metabolizzati dalle leishmanie. L’attività leishmanicida del farmaco si esercita colpendo la via del metabolismo dei fosfolipidi del parassita, interferendo quindi con le vie di comunicazione cellulare e inibendo la sintesi della membrana cellulare parassitaria. Due sono i meccanismi d’azione del farmaco: inibizione della biosintesi dei recettori del GPI (glicosilfosfatidil-inositolo), molecola chiave per la sopravvivenza intracellulare degli amastigoti di Leishmania e azione sulle fosfolipasi C e proteinasi C Leishmania-specifiche, interferendo quindi con il segnale di trasduzione. Ne consegue la morte per apoptosi della cellula protozoo aria. Il protocollo di trattamento prevede la somministrazione della miltefosina nel cibo del cane, una volta al giorno per 28 giorni. Negli studi effettuati, la miltefosina si è dimostrata efficace nel ridurre significativamente i segni clinici, che iniziano a migliorare subito dopo l’inizio del trattamento e diminuiscono in modo significativo dopo la seconda settimana di terapia. Non è possibile parlare di guarigione completa e di sterilizzazione dell’animale, ma senz’altro di un notevole miglioramento della qualità della vita del paziente Il farmaco, in soluzione liquida, comporta l’innegabile vantaggio di essere somministrabile per via orale Allopurinolo, parassito statico, utile nei soggetti asintomatici ma positivi. Attivo anche in associazione con Glucantime fiale. Aminosidina attiva contro leishmania ma può dare insufficienza renale -Amfotericina B, utile ma molto tossica.